Лекция 5. Энергетика химических реакций.
План лекции
Основные понятия химической термодинамики. Внутренняя энергия. Первый закон термодинамики. Энтальпия. Экзо- и эндотермические реакции. Термохимические уравнения. Энтальпия. Изменение энтальпии в ходе химического превращения. Термохимические законы. Закон Гесса и следствия из него. Второй закон термодинамики. Энтропия. Влияние температуры на величину энтропии. Изменение энтропии системы при фазовых превращениях и при протекании химических реакций. Энергия Гиббса – критерий и движущая сила самопроизвольных процессов в закрытой системе (p = const). Изменение энергии Гиббса и направление протекания химической реакции. Роль энтальпийного, энтропийного факторов и температуры в оценке возможности протекания химических реакций при различных температурах.
Задачи изучения темы:
В процессе освоения темы студенты получают представление о законах термодинамики, стандартных функциях состояния, их зависимости от параметров состояния. Энтропия, изменение энтропии системы при фазовых превращениях и при протекании химических реакций. Роль энтальпийного, энтропийного факторов и температуры в оценке возможности протекания химических реакций при различных температурах.
Студент должен знать:
Первый закон термодинамики. Понятие о экзо- и эндотермических реакциях. Термохимические уравнения. Изменение энтальпии в ходе химического превращения. Термохимические законы. Закон Гесса и следствия из него. Влияние температуры на величину изменения энтальпии реакции. Понятие энтропии. Второй закон термодинамики. Стандартная энтропия образования вещества. Влияние температуры на величину энтропии. Энергия Гиббса как критерий и движущая сила самопроизвольных процессов. Изменение энергии Гиббса и направление протекания химической реакции.
Основная и дополнительная литература
Основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов / Под ред. А.И. Ермакова. – изд. 28-е, перераб. и доп. – М.: Интеграл-Пресс, 2000. – С. 27-36.
2. Ахметов Н.С. Общая и неорганическая химия. М: Высш.шк., 2005. 743 с.
3. Угай Я.А. Общая и неорганическая химия. М: Высш.шк, 2004. 527 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / под ред. В.А. Рабиновича и др. М.: Интеграл-Пресс, 1997. – 240 с.
Дополнительная
5. Некрасов Б.В. Основы общей химии. СПб-М: Высш.шк, 2003 Т. 1, 2.
6. Коровин Н.В. Общая химия. М: Высш.шк., 2005. 557 с.
7. Практикум по общей и неорганической химии: Пособие для студентов вузов. / В.И. Фионов, Т.М. Курохтина, З.Н. Дымова и др.; Под ред. Н.Н. Павлова, В.И. Фролова. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002. – С. 33-47.
Методические разработки кафедры
8. Гаркушин И.К., Лисов Н.И., Немков А.В. Общая химия для технических вузов. Учебное пособие. Самарск. гос. техн. ун-т, Самара. – 2003. – С. 144-166.
9. Лисов Н.И., Немков А.В. Определение изменения энтальпии химических реакций. Метод. указания к самостоятельной работе студентов.
Основные понятия химической термодинамики.
Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика.
Применение законов термодинамики в химии позволяет решить вопросы:
1) перехода энергии из одной формы в другую, от одной части системы к другой;
2) изучения энергетических эффектов, сопровождающих химические и физические процессы;
3) возможности и направления самопроизвольно протекающих процессов.
Система – тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособленных от нее. Внешняя среда – вещества, окружающие систему.
Различают открытую, закрытую и изолированную системы.
Система называется открытой, если через границу (реальную или условную), разделяющую систему и внешнюю среду, может происходить обмен веществом и энергией, например, жидкость и ее пар.
Система называется закрытой, если она может обмениваться энергией, например, газ в баллоне, твердые или жидкие вещества в изолированном сосуде. Изолированная система не в состоянии обмениваться с внешней средой ни веществом, ни энергией, например, запаянная ампула, полностью изолированная от внешней среды.
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения могут превращаться друг в друга. В превращениях, происходящих в ходе химических реакций, участвуют, как правило, тепловая энергия Q и механическая (или работа А). Единица измерения энергии – джоуль (Дж).
Тепловая и механическая энергия – алгебраические величины. Знаки величин тепловой энергии и механической в термодинамике рассматриваются по отношению к системе. Энергия, получаемая системой, обозначается знаком "+", отданная системой – знаком "–".
Переменные величины, определяющие состояние системы, называются параметрами состояния. Среди них в химии наиболее часто используются давление, температура, объем, состав системы. Состояние системы и происходящие в ней изменения характеризуются также с помощью функций состояния, зависящих от параметров состояния и не зависящих от пути перехода системы из одного состояния в другое. К ним относятся внутренняя энергия, энтальпия, энтропия, изобарно-изотермический потенциал.
Процессы перехода системы могут происходить при постоянстве каких-то параметров системы, так:
протекающие, при постоянном давлении – изобарные (в открытой колбе);
Большинство химических реакций протекают в открытых сосудах, т. е. при постоянном давлении, равном атмосферному.
при постоянном объеме – изохорные (в автоклаве);
при постоянной температуре – изотермические.
Внутренняя энергия. Первый закон термодинамики. Энтальпия.
В любом процессе соблюдается закон сохранения энергии. Этот закон называется первым началом термодинамики и выражается равенством
Q = DU + A
Данное равенство означает, что если к системе (веществу или совокупности веществ) подводится теплота Q, то в общем случае она расходуется на изменение внутренней энергии DU и на совершение работы А.
Под внутренней энергией системы U подразумевается общий ее запас – включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов в атомах, внутриядерную энергию и т. д., т. е. все виды энергии, кроме кинетической и потенциальной энергии системы в целом.
Определить можно лишь изменение внутренней энергии DU = U2 – U1, где U2 и U1 – внутренняя энергия системы в состоянии 2 и 1 соответственно.
Согласно закону сохранения энергии изменение внутренней энергии DU зависит только от начального и конечного состояния системы, но не зависит от способа осуществления процесса.
Под величиной А, имеют в виду, работу против всех сил, действующих на систему (т.е. рассматривается работа расширения направленная против внешнего атмосферного давления).
Для изохорного процесса (V = const) А = 0 и тепловой эффект реакции соответствует изменению внутренней энергии системы в ходе реакции QV = DU
Для изобарного процесса (Р = const). Поскольку большинство химических процессов проводят в открытых сосудах, т.е. при постоянном атмосферном давлении, но изменении объема системы DV = V2 – V1,
то А = рDV
и Qp = DU + рDV
Qp = (U2 + рV2) – (U1 + рV1)
Сумму внутренней энергии и произведения объема вещества на внешнее давление называют энтальпией (от греческого «энтальпо» – нагреваю) и обозначают буквой H:
H = U + рV, отсюда Qp = Н2 –Н1 = DН, т.е. тепловой эффект при постоянном давлении и температуре соответствует изменению энтальпии в ходе реакции.
Энтальпия DH [кДж/моль] подобно объему, давлению, температуре и внутренней энергии является функцией (характеристикой) состояния системы.
Химические процессы протекают либо с выделением (экзотермические), либо с поглощением теплоты (эндотермические).
Количество выделений (или поглощенной) теплоты называют тепловым эффектом процесса.
Химические уравнения, в которых указан тепловой эффект реакции и агрегатное состояние вещества, называют термохимическими уравнениями.
Тепловой эффект считают положительным DH > 0, для эндотермических процессов и отрицательным (DH < 0) для экзотермических. Значение DH реакции указывают после уравнения реакции. Значение DH относят к числу молей веществ, участвующих в реакции, которое указывают стехиометрическими коэффициентами (часто они бывают дробными). Кроме того, в термохимических уравнениях отмечают состояние веществ: (к) – кристаллическое, (ж) – жидкое, (г) – газообразное.
Если специально не оговорено, то DH приводится для стандартной температуры 25°С (298,15 К) и стандартного давления 101 кПа (1 атм).
Так запись H2 (г) + 1/2О2(г) ® H2O(г); DH 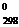 = – 285,84 кДж
= – 285,84 кДж
означает, что превращение одного моля газообразного водорода и 0,5 моль газообразного кислорода в 1 моль воды при 25°С и 101 кПа сопровождается выделением 285,84 кДж теплоты.
Энтальпия реакции в которой образуется 1 моль вещества из простых соединений в стандартных условиях называется энтальпией образования веществ, и обознается DH 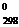 .
.
Стандартная энтальпия образования соединения – это мера его термодинамической устойчивости, прочности. Количественное выражение энергетических свойств соединения. Чем меньше стандартная энтальпия образования соединения, тем оно устойчивее.
Энтальпия образования простых веществ в стандартном состоянии принимается равной 0, т. е. DH°298(O2) = 0, DH°298(C(графит)) = 0, однако DH°298(O3) = 142,3 кДж/моль, DH°298(C(алмаз)) = 1,828 кДж/моль.
Энтальпия образования соединений может быть как отрицательной, так и положительной.
Эндотермические соединения (DH°298 > 0) неустойчивы и склонны к распаду. Получают их, как правило, не прямым синтезом из простых веществ, а косвенным путем.
В ряду однотипных соединений чем меньше стандартная энтальпия образования соединения DfH°298, тем больше его термическая устойчивость относительно разложения на простые вещества.
Термохимические законы
1.Закон Лавуазье-Лапласа
Тепловой эффект реакции образования какого-либо химического соединения равен тепловому эффекту разложения этого соединения с обратным знаком, например:
1/2H2 (г) + 1/2Сl2(г) ® HCl(г); DH°298 (HCl) = – 92 кДж
HCl(г) ® 1/2H2 (г) + 1/2Сl2(г); DH°298 = + 92 кДж.
2.Закон Гесса
Основной закон термохимии был сформулирован русским ученым Г. И. Гессом (1940 г.):
Тепловой эффект химической реакции определяется лишь начальным и конечным состоянием системы и не зависит от пути перехода системы из первого состояния во второе.
Наиболее важно следствие из закона Гесса: тепловой эффект реакции равен сумме энтальпий образования, (DH) продуктов реакции за вычетом суммы теплот образования исходных веществ.
DH = 
Для реакции в общем виде аА + bB ® cC + dD
Если в уравнении реакции имеются стехиометрические коэффициенты, их необходимо учитывать при суммировании.
DH = [c DH(C) + d DH (D)] – [a DH(A) + b DH(B)]
Пример: Вычислить тепловой эффект реакции горения бензола по стандартным энтальпиям образования
С6Н6(ж) + 7/2О2(г) = 6СО2(г) + 3Н2О(ж)
DH°298 40,6 0 – 394,7 – 286
Воспользуемся следствием из закона Гесса:
DH° = 6DH°(СО2(г)) + 3DH°(Н2О(ж)) – DH°(С6Н6(ж)),
DH° = 6(– 394,7) +3 (– 286) – (+ 40,6) = – 3186,8 кДж.
Энтропия
Вследствие теплого движения частицы (атомы, ионы, молекулы) стремятся изменить свое состояние (смешаться, рассеяться, продифундировать) – система стремится перейти из упорядоченного состояния в состояние с большим беспорядком. Количественной мерой беспорядка является энтропия.
Энтропия системы – S  [Дж/(моль×К)] – мера неупорядоченности ее состояния.
[Дж/(моль×К)] – мера неупорядоченности ее состояния.
Энропия связана с термодинамической вероятностью реализации данного состояния вещества соотношением:
S = k lnW,
где k – постоянная Больцмана; W – термодинамическая вероятность, т. е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
В изолированных системах изменение энтропии служит критерием, определяющим направление процесса. Согласно второму началу термодинамики, в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т. е. DS > 0.
В закрытых системах энтропия в ходе процессов может как увеличиваться, так и уменьшаться. Увеличение энтропии происходит при переходе системы из более упорядоченного состояния в менее упорядоченное.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при увеличении объема газа, при химических взаимодействиях, приводящих к увеличению числа частиц.
Процессы, для которых DS > 0:
1)расширение газов;
2)фазовые превращения, в ходе которых вещество переходит от твердого к жидкому и газообразному состоянию;
Sтв.в. < Sжид. < Sгаз
SН2О (пар) = 183 Дж/(моль×К)
SН2О (жидк.) = 69 Дж/(моль×К)
SН2О (лед) = 43,89 Дж/(моль×К)
3)растворение кристаллических веществ.
Все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие), сопровождаются уменьшением энтропии.
Процессы, для которых DS < 0:
1)сжатие газов;
2)конденсация и кристаллизация веществ.
В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул по мере усложнения состава молекул:
Вещество S 
HF 173,5
HCl 186,4
HBr 198,1
HI 206,5
Энтропия, как и энтальпия, – функция состояния системы, поэтому изменение энтропии DS в ходе превращения системы определяется только начальным и конечным состоянием системы и не зависит о пути протекания процесса.
S  =
= 
Для химической реакции в общем виде аА + bB ® cC + dD
DS  = сS(С) + dS(D) – aS(A) – bS(B).
= сS(С) + dS(D) – aS(A) – bS(B).
Изменение энтропии в ходе реакции образования соединения из простых веществ называют энтропией образования соединения.
Стандартная энтропия образования простых веществ не равна нулю:
Пример. Предскажите знак изменения энтропии (DS  ) в каждой из предлагаемых реакций:
) в каждой из предлагаемых реакций:
1)2KClO3(к) = 2KCl(к) + 3О2(г)
2)N2(г) + 2О2(г) = 2NO2(г)
3)C2Н2(г) = С6Н6(ж)
Решение.
1) DS  > 0, из кристаллического вещества в ходе реакции образуется газообразное, мера неупорядоченности возрастает.
> 0, из кристаллического вещества в ходе реакции образуется газообразное, мера неупорядоченности возрастает.
2)DS  < 0, так как вступают три объема газов, а получаются два, т. е. число частиц газообразных веществ уменьшается, в системе растет упорядоченность.
< 0, так как вступают три объема газов, а получаются два, т. е. число частиц газообразных веществ уменьшается, в системе растет упорядоченность.
3)DS  < 0, из газа образуется жидкость – в системе растет упорядоченность.
< 0, из газа образуется жидкость – в системе растет упорядоченность.