Свойства d-элементов (2 часть).
Теоретическая часть
Железо, кобальт, никель составляют «семейство» железа.
Проявляют степень окисления главным образом +2 и +3. Степень окисления +3 более характерна железа, +2 для кобальта и никеля.
Родственные черты этих металлов проявляются в свойственной им ферромагнитности, каталитической активности, способности к образованию окрашенных ионов, комплексообразовании. Однако при схожести свойств, железо по своим магнитным свойствам ярко выделяется в триаде. Восстановительная активность железа значительно больше, чем кобальта и никеля (смотри электродные потенциалы). Все эти металлы со щелочами не взаимодействуют. При растворении в неокисляющих кислотах образуют ионы Fe2+, Co2+, Ni2+

В разбавленной азотной кислоте (сильном окислителе) образуются ионы Fe3+, Co3+, Ni3+

Сильная окислительная среда: H2SO4 (конц.), HNO3 (конц.) пассивирует железо и оно начинает реагировать лишь при нагревании:
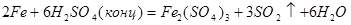
В азотной кислоте, содержащей соли NaNO2 и NaNO3, железо пассивируется с образованием пленки оксида высшей степени окисления FeO3
В ряду гидроксидов: Fe(OH)2 — Co(OH)2 — Ni(OH)2
 восстановительная способность падает
восстановительная способность падает
Гидроксид железа (II) легко окисляется кислородом воздуха:

Окисление ионов Co2+ происходит труднее и протекает медленно:

Более интенсивно идет процесс при добавлении в раствор пероксида водорода:

Самопроизвольного окисления Ni(OH)2 кислородом воздуха не происходит, H2O2 является также не достаточно сильным окислителем и процесс окисления Ni(OH)2 становится возможным лишь при использовании более сильного окислителя, например бромной воды:

Гидроксиды Fe (III), Co (II), Co (III), Ni (II), Ni (III) носят в обычных условиях основной характер. При растворении в кислотах Co(OH)3 и Ni(OH)3 проявляют сильные окислительные свойства и восстанавливаются до катионов Co2+ и Ni2+.
Гидроксид железа (III) при кипячении с концентрированным раствором щелочи образует ферриты - соли железистой кислоты.
Таким образом гидроксид Fe(OH)3, проявляет амфотерные свойства.
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) нерастворимы
Гидроксиды Fe (II), Fe (III), Co (II), Co (III), Ni (II) являются слабыми основаниями, поэтому их соли в водных растворах гидролизуются.


Эти процессы идут без нагревания.
Однако гидролиз солей не идет до конца вследствие накопления в растворе H+. При сильном разбавлении и нагревании гидролиз идет дальше:

При кипячении раствора FeCl3 процесс гидролиза можно провести необратимо:

При подкислении растворов солей соответствующими кислотами степень их гидролиза уменьшается, так как равновесие сдвигается в сторону исходных веществ.
При сильном разбавлении степень гидролиза увеличивается. При добавлении растворимых карбонатов - происходит необратимой гидролиз, так как продукты реакции уходят из сферы взаимодействия.
Соли Fe (II) на воздухе постепенно переходят в соли Fe (III).
В комплексных соединениях Fe, Co, Ni являются центральными ионами комплексообразователями с координационными числами 4 или 6.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Опыт № 3 Получение и свойства гидроксида железа (II).
К раствору соли железа (II) подливаем раствор щелочи NaOH до образования осадка, затем осадок разделить на три части:
а) в первую пробирку добавляем избыток щелочи;
б) во вторую - кислоту;
в) осадок из третьей пробирки отфильтровать и дать ему постоять на воздухе.
В присутствии влаги и кислорода воздуха гидроксид железа (II) переходит в гидроксид железа (III).



1. 

 (Цвет не меняется. Реакция не идет)
(Цвет не меняется. Реакция не идет)
2.  (Цвет изменяется на грязно-зеленый)
(Цвет изменяется на грязно-зеленый)
3.  Фильтрование (2) осадок на воздухе окисляется (ржавеет)
Фильтрование (2) осадок на воздухе окисляется (ржавеет)
Опыт № 4 Характерная реакция на ион Fe2+.
Наливаем в пробирку немного соли железа (II) и добавляем небольшое количество раствора красной кровяной соли K3[Fe(CN)6]. Эта реакция применяется для открытия ионов железа (II).

Вывод: Красная кровяная соль K3[Fe(CN)6] является реактивом на ион железа (II).
Опыт № 5 Получение и гидролиз карбоната железа (II).
К раствору соли железа (II) добавляем раствор карбоната натрия. Образовавшаяся белая углекислая соль железа (II) мгновенно подвергается гидролизу с образованием гидроксида железа (II).
1. 
2. 


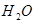

Вывод: соль, образованная слабой кислотой гидролизуется до конца, т.к. H2CO3 распадается на H2O и CO2 и Þ H2CO3 полностью удаляется из сферы реакции.