АМИНОКАРБОНОВЫЕ КИСЛОТЫ, БЕЛКИ
Схема лекции.
1. Аминокислоты
1.1. Классификация, номенклатура, изомерия.
1.2. Способы получения
1.3. Химические свойства
1.4. Оптическая изомерия
2. Белки
2.1 Классификация
2.2. Пептидная связь
АМИНОКИСЛОТЫ
Определение: Органические соединения содержащие в молекуле карбоксильную и аминогруппы, называются аминокислотами. Из остатков аминокислот построены белки – основной материал, из которого состоят объекты живой природы. Поэтому аминокислоты имеют огромное значение.
Классификация, номенклатура, изомерия.
26 α-аминокислот, из которых построены белки, имеют собственные названия. Например: глицин, аланин, валин, серин и т.д. Рациональная номенклатура строится по тривиальному названию карбоновой кислоты в префиксе ставится «амино» и буквой греческого алфавита обозначается положение гидроксигруппы. По систематической номенклатуре локантом обозначается положение аминогруппы. Карбоксильная группа всегда занимает первое положение. Название строится по углеводороду с добавкой префикса «амино» и суффиксов «овая» или «диовая».
Гомологический ряд одноосновных аминокислот начинается с аминомуравьиной или неполного амида угольной кислоты. Затем идет глицин или аминоуксусная, Эти две кислоты не имеют структурных изомеров. Изомерия аминокислот связана с положением аминогруппы и строением углеродного скелета. Поэтому у следующей карбоновой кислоты – пропионовой – молгут быть два изомера, различающихся положением аминогруппы: α-амино пропионовая и β- мино пропионовая кислота. Кислота с четырьмя углеродными атомами может существовать в виде пяти изомеров. Три соответствуют н -масляной кислоте и два изомасляной кислоте.
Все природные аминокислоты, кроме аминоуксусной, содержат асимметрический атом углерода. Все они относятся к L-ряду.

Способы получения
Получение α-аминокислот:
Гидролизом белков.
Действием аммиака на α-галоидкарбоновые кислоты:

Получение по методу Штреккера-Зелинского
По этому методу альдегид обрабатывают водным раствором смеси цианистого калия и хлорида аммония:

Получение β-аминокислот:
Присоединение аммиака к α,β-ненасыщенным кислотам:

Получение по методу Родионова:
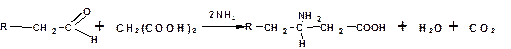
Способы получения других аминокислот
Получение γ-аминокислоты из левулиновой кислоты:

Аминокислоты с более удаленными друг от друга функциональными группами получают перегруппировкой Бекмана. Например, получение капролактама и ω-аминокислоты (ω-капроновой кислоты):

Ароматические аминокислоты
пара - и мета -Аминобейзойные кислоты получают восстановлением соответствующих нитробензойных кислот:

орто -Изомер., так называемую антраниловую кислоту получают из фталевого ангидрида, через фталимид действием гипобромита:

Химические свойства
Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, которые мало отличаются для разных аминокислот и поэтому не характерны. Плавление сопровождается разложением векщества. Плавление с разложением характерно для солей. Будучи солями аминокислоты хорошо растворимы в воде. Водный раствор аминокислот имеет нейтральную реакцию, что также характерно для солей. Аминокислоты представляют собой так называемые внутренние соли (биполярные ионы):

Такой ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы, а в щелочной среде аминокислота ведет себя как анион:
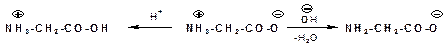
Значение рH при котором достигается максимальная концентрация биполярного иона – называется изоэлектрической точкой.
Подобно другим соединениям со смешанными функциями, аминокислоты проявляют свойства кислот и аминов.
Аминокислоты образуют соли с основаниями. Соли α-аминокислот с тяжелыми металлами могут иметь комплексный характер:

соль имеет интенсивно синее окрашиваание.
Аминокислоты образуют соли с неорганическими кислотами:

Подобно другим кислотам, аминокислоты образуют сложные эфиры, хлорангидриды, амиды и т.д:
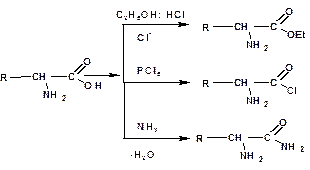
При действии азотистой кислоты аминокислоты образуют гидроксикислоты:
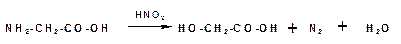
Аминогруппа в аминокислотах легко ацилируется при действии ангидридов и хлорангидридов кислот:

При алкилировании аминогруппы получаются вторичные и третичные аминокислоты. В избытке галоидного алкила образуются четырехзамещенныеаммонийные основания. Внутренние соли таких оснований называются бетаинами:

Поведение α, β и γ-аминокислот при нагревании:
α-аминокислоты межмолекулярно образуют циклические амиды – дикетопиперазины:

β-аминокислоты при нагревании отщепляют молекулу аммиака с образованием α,β-ненасыщенных кислот (аммонийная соль):

γ и δ-аминокислоты при нагревании отщепляют воду и образуют внутримолекулярные циклические амиды – лактамы:

БЕЛКИ
Классификация
Определение: Белки – это сложные высокомолекулярные органические соединения, построенные из остатков аминокислот, соединенных между собой амидными связями.
Белки разделяются на протеины (простые белки), в состав которых входят только остатки аминокислот и протеиды (сложные белки). Это белки построенные не только из аминокислот, но и из других веществ: сахаридов или остатков фосфорной кислоты и нуклеиновые кислоты.
Протеины классифицируются по трем группам.
1. По растворимости в воде:
Альбумины - растворимые в воде и разбавленных растворах солей.
Глобулины – мало растворимые в воде и растворимые в разбавленных растворах солей.
Проламины – нерастворимые в воде и растворимые в водном спирте.
Глютелины - нерастворимые в воде, в разбавленных растворах солей и водном спирте, растворимы в растворах кислот и щелочей.
Склеропротеины - нерастворимые в воде, в разбавленных растворах солей, водном спирте и в растворах кислот и щелочей.
2. Протеиды классифицируются по продуктам гидролиза:
Нуклеопротеиды – гидролизуются на протеины и нуклеиновые кислоты.
Фосфопротеиды - гидролизуются на протеины и фосфорную кислоту.
Глюкопротеиды - гидролизуются на протеины и углевод.
Хромопротеиды - гидролизуются на протеины и красящие вещества.
3. Все белки классифицируются по функциям в организме:
Резервные белки
Структурные белки
Белки, управляющие метаболизмом.
Как и аминокислоты, белки обладают амфотерным характером и изоэлектрической точкой. Положение изоэлектрической точки для белков может колебаться в широких пределах от кислой до сильнощелочной.
Все белки оптически активны. Большинство из них обладает левым вращением.
Существует ряд качественных цветных реакций на белки:
1. Ксантопротеиновая с азотной кислотой. Белки обработанные азотной кислотой дают желтое окрашивание.
2. Биуретовая с солями меди в присутствии щелочи. Белки дают фиолетовую окраску за счет образования комплексной соли.
3. Реакция Миллона. С раствором нитрата ртути в азотистой кислоте белки дают красное окрашивание.
4. Сульфгидрильная. При нагревании белков с раствором плюмбита натрия выделяется черный осадок сульфида свинца.
Белки построены из остатков 26 аминокислот. Аминокислоты делятся на заменимые, которые могут быть синтезированы организмом и незаменимые, которые человеческим организмом не синтезируются. Например, изолейцин и треонин.
Остатки аминокислот связаны в белковой молекуле амидными связями. Амидная связь в белках называется пептидной связью:

Карбоксильная группа одной молекулы аминокислоты образует амид, взаимодействуя с аминогруппой соседней молекулы аминокислоты. Отдельные пептидные звенья:

отличаются друг от друга только радикалами «R» при α-углеродном атоме.
Соединения, содержащие несколько аминокислотных остатков, называются пептидами. Соединения с большим количеством пептидных звеньев называются полипептидами.
При исследовании полипептидов в первую очередь выясняют из каких аминокислот построена макромолекула, а также какая аминокислота является N-концевой (свободная аминогруппа), а какая является С-концевой (свободная корбоксильная группа).
Белки нацело гидролизуются в аминокислоты концентрированной соляной кислотой или 2% соляной кислотой при нагревании и при повышенном давлении. Гидролиз белков можно провести под действием щелочи. Выбор реагента зависит от того, какие конкретно аминокислоты необходимо получить из молекулы белка.
Определение N-концевой аминокислоты
Проводят с использованием 2,4-динитрофторбензола:
При взаимодействии 2,4-динитрофторбензола с пептидом фтор нуклеофильно замещается на концевую аминогруппу. Затем пептид подвергают гидролизу. Продукт взаимодействия концевой аминокислоты с 2,4-динитрофторбензолом выделяют и кислоту идентифицируют. В тех случаях, когда 2,4-динитрофторбензол неприменим - используют фенилизотиоцианат.

Определение С-концевой аминокислоты:
Для определения С-концевой аминокислоты (со свободным гидроксилом) пептид нагревают с гидразином при 1000С несколько часов. При этом все аминокислоты, кроме концевой, образуют гидразиды:

Аминокислоту, не образовавшую гидразид, выделяют и идентифицируют.
Более простой метод заключается в применении фермента карбоксипептидазы, который расщепляет пептидную связь только С-концевой аминокислоты. Ее можно выделить и идентифицировать.
Построение полипептидной цепи проводят по методу Э.Фишера. Метод основан на применении хлорангидридов α-галогензамещеннх кислот. Например, надо получить цепи:
Глициналанин (Gly-Ala):
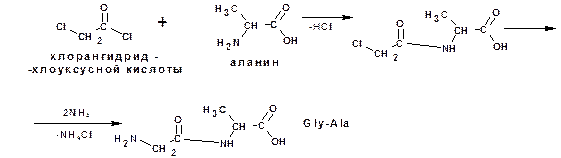
и аланинглицинвалин (Ala-Gly-Val):

Последовательность аминокислот, ковалентно связанных между собой в полипептиде, составляет так называемую первичную структуру белка. Но собственно полипептид белком еще не является. Пептиды неспособны к функционированию. Выполнять какие либо функции в организме способны более сложные системы построенные из нескольких полипептидных цепей, определенным образом связанных друг с другом. Надмолекулярные структуры, сформированные полопептидными цепями, характеризуются вторичной, третичной и четвертичной структурой белка.
Вторичная структура обусловлена водородными связями между пептидно не связанными кислородом карбонильной группы и водородом аминной группы. Если карбонил и аминная группа принадлежат разным полипептидным цепям, то такая вторичная структура называется β-структурой. Если карбонил и аминная группа принадлежат одной и той же полипептидной цепи, то такая вторичная структура называется α-структура. Следствием α-структуры является существование полипептидной цепи в форме спирали навитой на циллиндр. Длина одного остатка 1,5 А0, длина шага спирали 5,4 А0. Водородные связи α-спирали образуются между каждой первой и четвертой аминокислотой.
Третичная структура белка формируется в результате складывания или свивания нескольких α-спиралей. При этом спирали удерживаются друг около друга за счет образования водородных связей, образованных боковыми амино-, гидрокси- и карбоксильными группами, а также дисульфидными связями и электростатически.
Четвертичная структура формируется как агрегат нескольких полипептидных цепей, имеющих вторичную и третичную структуры. Полипептидные цепи удерживаются в четвертичной структуре теми же силами, что и в третичной структуре.
Разрушение первичной вторичной, третичной и четвертичной структуры белка называется денатурацией. Денатурация может быть вызвана термически (нагревание), химически, механически и т. д. При этом денатурация бывает обратимой и необратимой. Необратимой являются денатурация, связанная с разрушением первичной и вторичной структуры. После их разрушения белок самопроизвольно не восстанавливается. Например, гидролиз белков или варка яиц или мяса, взбивание яичного белка. Денатурация третичной и четвертичной структуры является обратимой. После их разрушения белки могут самопроизвольно восстанавливаться с возвращением биологических функций. Например, накручивание волос на бигуди (термическая денатурация) или химическая завивка.